Auteur : Nuno Anjo
La maladie de Creutzfeldt-Jakob sporadique (MCJS) est une maladie neurodégénérative rare, mortelle et rapidement évolutive pour laquelle il n'existe toujours pas de traitement efficace. Elle se caractérise par un mauvais repliement de la protéine prion normale (PrPC) sous une forme anormale appelée PrPSc ou Prion, qui s'accumule dans le cerveau, provoquant des lésions neuronales et une dégénérescence spongiforme. Bien qu'elle représente 80 % des maladies humaines à prion et que son étiologie soit mal comprise, cette étude ouvre de nouvelles perspectives pour le développement de traitements. Des chercheurs chinois ont mené une étude novatrice en utilisant une approche multiomique intégrative pour identifier des cibles thérapeutiques potentielles pour la sCJD. L'approche intégrative combine des données sur l'expression des gènes, la méthylation de l'ADN et les niveaux de protéines dans le sang et les tissus cérébraux afin d'identifier les gènes et les voies pertinentes pour la maladie de Creutzfeldt-Jakob.
L'étude a analysé les données génétiques de 4 110 patients atteints de la sCJD et de 13 569 témoins, obtenues à partir d'échantillons de cerveau et de sang dans le cadre d'études d'association à l'échelle du génome (GWAS). Les chercheurs ont utilisé une analyse multi-omique pour identifier les régions génomiques (QTL) qui influencent l'expression des gènes (eQTL), la méthylation de l'ADN (mQTL) et les niveaux de protéines (pQTL), fournissant ainsi des indices sur les mécanismes moléculaires impliqués. Les QTL sont des régions du génome qui influencent ces caractéristiques moléculaires et peuvent fournir des indices sur la manière dont les gènes sont impliqués dans les maladies. En outre, ils ont utilisé des données d'expression génique sur une seule cellule (sc-eQTL) pour analyser la manière dont ces variantes génétiques affectent différents types de cellules cérébrales. Les chercheurs ont ainsi pu établir un lien entre les modifications moléculaires des gènes et leur impact sur des tissus et des cellules spécifiques.
Pour confirmer que les gènes identifiés jouent effectivement un rôle causal dans la sCJD, ils ont utilisé une méthode statistique appelée randomisation mendélienne (RM). Cette approche utilise les variantes génétiques comme outils pour établir des relations causales entre les gènes et la maladie, en minimisant les biais dus à des facteurs externes et en évitant les confusions causées par des relations indirectes. En outre, ils ont effectué des analyses de colocalisation pour déterminer si les mêmes variantes génétiques étaient impliquées à la fois dans les traits moléculaires et dans le risque de MCJ. Cette approche leur a permis d'identifier les gènes dont l'influence sur la maladie était plus robuste et moins susceptible d'erreurs d'interprétation.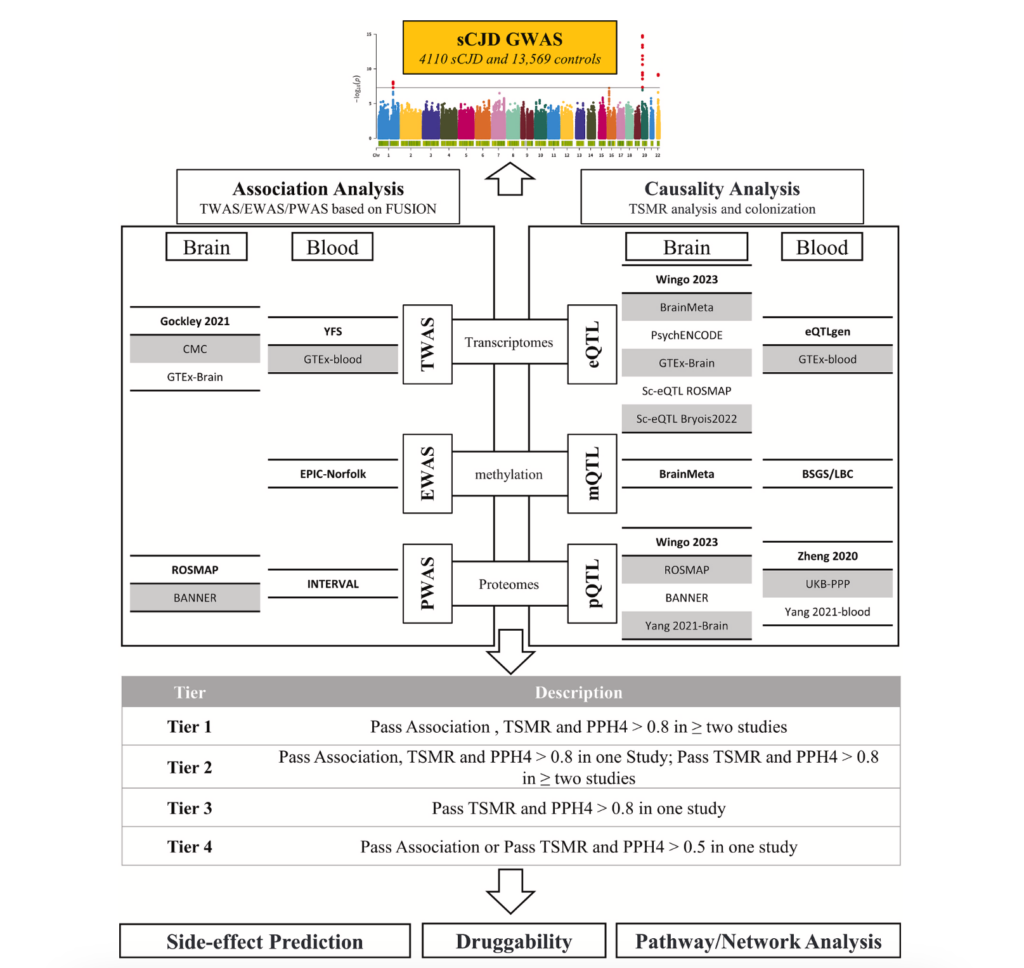
L'analyse a révélé 23 gènes associés à la sCJD, dont cinq présentant le niveau de preuve le plus élevé : STX6, XYLT2, PDIA4, FUCA2 et KIAA1614. Le gène STX6 s'est avéré le plus pertinent, car son expression accrue dans des régions cérébrales telles que l'hippocampe et le cortex, qui sont généralement touchées par la maladie, a été associée à un risque accru de sCJD. STX6 code pour une protéine impliquée dans le transport des vésicules et la communication neuronale, des processus clés qui sont altérés dans la maladie. Un autre gène clé identifié est XYLT2, qui code pour une enzyme impliquée dans la synthèse de protéoglycanes sulfatés, des molécules qui interagissent avec les protéines prions mal repliées. Ce gène pourrait constituer une cible thérapeutique intéressante, car les chercheurs suggèrent que des médicaments tels que le carboplatine et la gemcitabine, actuellement utilisés dans le traitement du cancer, pourraient être réaffectés au traitement de la sCJD. Toutefois, d'autres études sont nécessaires pour évaluer leur innocuité et leur efficacité dans ce contexte.
Les protéines codées par ces gènes sont liées à des processus essentiels tels que le repliement des protéines, la communication neuronale et la réponse au stress cellulaire. Par exemple, PDIA4, un autre gène identifié, code pour une protéine du réticulum endoplasmique impliquée dans le repliement correct des protéines. Les résultats suggèrent que des défauts dans ces processus peuvent contribuer au développement de la maladie, soit par la perte de fonctions normales, soit par l'acquisition de propriétés toxiques dans les protéines affectées.
Ces travaux ont ouvert la voie à l'utilisation d'approches multi-omiques pour étudier les maladies à prions. Les chercheurs ont non seulement identifié des cibles thérapeutiques potentielles, mais ils ont également jeté les bases d'une meilleure compréhension des mécanismes biologiques sous-jacents de la sCJD. Les résultats soulignent l'importance de l'intégration de plusieurs types de données biologiques pour obtenir une image plus complète des maladies complexes. En outre, la possibilité de réaffecter des médicaments approuvés accélère la voie vers des thérapies potentielles, même si des essais cliniques rigoureux seront nécessaires pour valider ces propositions. Cette étude représente une étape importante dans la recherche sur la sCJD, en identifiant des cibles thérapeutiques potentielles et en ouvrant la voie à des traitements ciblés, offrant ainsi un nouvel espoir aux patients et à leurs familles.
Voir l'article original ici (en anglais).